셀트리온 '짐펜트라' 미국서 제형 특허 등록 완료
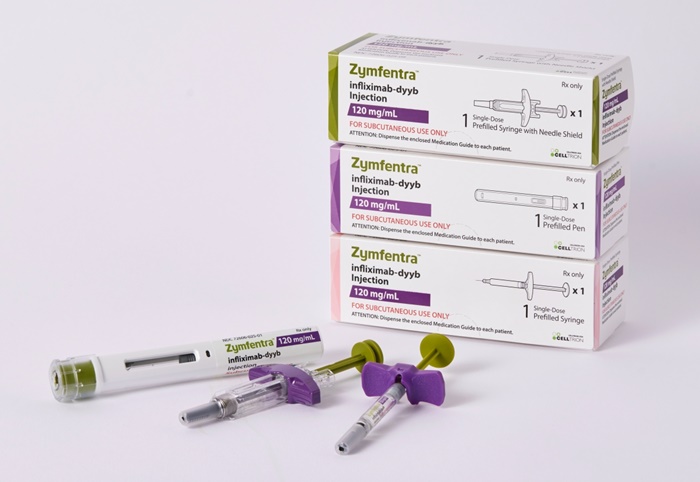
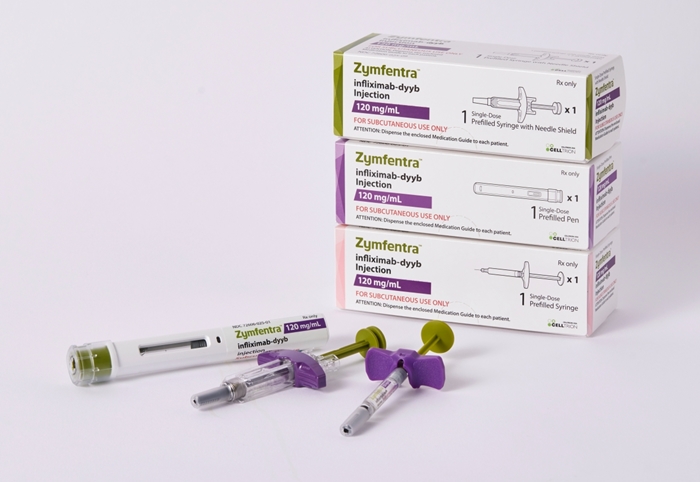
메디칼타임즈=허성규 기자셀트리온은 자체 개발한 세계 최초의 인플릭시맙 피하주사(SC) 제형 자가면역질환 치료제 '짐펜트라'(ZYMFENTRA, 램시마SC 미국 브랜드명)가 현지시간 9일 미국 특허청(USPTO)에 제형 특허 등록을 완료했다고 11일 밝혔다.셀트리온의 인플릭시맙 피하주사(SC) 제형의 '짐펜트라'짐펜트라는 종양괴사인자(TNF-α) 억제제 중 넓게 쓰이는 정맥주사(IV) 형태의 인플릭시맙을 셀트리온이 피하주사(SC) 제형으로 자체 개발한 치료제다. 이미 유럽 등 글로벌 주요 시장에서 유효성과 편의성을 인정받았고, 지난해 10월 미국 식품의약국(FDA)에서 신약으로 허가 받아 지난달부터 시장 공급 절차를 진행 중이다.이번에 등록한 특허는 셀트리온이 짐펜트라를 미국 시장에 신약으로 내놓은 가운데, 향후 경쟁사의 SC 제형 인플릭시맙 바이오시밀러의 시장 진입을 방어할 수 있도록 구성된 장벽 특허다. 해당 특허 만료 시점인 2038년까지 미국 시장에서 짐펜트라의 독점적 권리를 확보했다. 이미 출원을 마친 투여법 특허까지 등록하면 최대 2040년까지 특허 보호를 받을 것으로 기대하고 있다.셀트리온은 짐펜트라의 특허 전략을 통해 미국 시장 내 확고한 지위를 구축하는 한편, 바이오시밀러 대비 가격이 높은 신약으로 출시하는 만큼 안정적인 중장기적 수익을 창출할 것으로 보고 있다.셀트리온은 앞서 유럽, 캐나다를 비롯해 한국, 일본, 호주, 대만 등 아시아 주요 국가에서도 램시마SC 제형 특허를 확보했다. 특허 등록을 통한 시장 내 제품 보호의 중요성이 대두되고 있어 앞으로도 글로벌 특허권 확보에 집중한다는 전략이다. 특히 세계 최대 규모의 시장인 미국에서는 다수의 특허 권리를 확보, 시장 내 타사 진입을 저지할 수 있는 촘촘한 방어막을 만들어갈 예정이다.의약품 시장조사기관 아이큐비아(IQVIA)에 따르면 인플릭시맙을 포함한 미국 TNF-α 억제제 시장의 규모는 2022년 기준 약 477억 3,600만 달러(62조 570억원)[1]로 세계 최대 수준이며, 이중 짐펜트라가 우선 타깃으로 하는 염증성장질환(IBD) 시장은 약 98억 2,700만 달러(약 12조 8,000억원)에 달한다.셀트리온 관계자는 "이번 짐펜트라의 제형 특허 등록으로 미국 내 독점적 지위는 물론 글로벌 경쟁력도 한층 더 강화하게 됐다"며 "높은 치료 편의성에 따라 짐펜트라를 비롯한 SC제형 치료제의 관심이 빠르게 확대되는 만큼, 글로벌 특허 전략에 집중해 시장 지배력을 공고히 하고 안정적인 매출을 올릴 수 있도록 최선을 다하겠다"고 말했다.